آلودگی جیوه در محیط زیست
محمد علی کاظمیپور • ۱ مهر ۱۳۸۶ • دانش • شماره ۱۳۸۶ - پاییزمقدمه
افزایش جمعیت تقاضا برای تولید محصولات گوناگون را به دنبال داشته است. رشد اقتصادی، پیشرفت صنایع و مدرنتر شدن تکنولژی علاوه بر فوایدی که برای بشر و تحولات مثبتی در زندگی او ایجاد کرده، مشکلاتی را نیز برای او فراهم کرده است، بارزترین این مشکلات ورود آلاینده های مختلف از طریق صنایع به محیط زیست می باشد، در این میان صنایع شیمیایی بدلیل وارد کردن ترکیبات غیر قابل تجزیه بیولژیک و تجمعپذیر مانند سموم دفع آفات، فلزات سنگین و از اهمیت ویژه ای برخوردار میباشد از جمله فلزات سنگینی که از طریق صنعت پتروشیمی وارد آب دریا میگردد، فلز سنگین جیوه است که بدلیل خطرناک بودن وجود این عنصر و ترکیبات آن در محیط باید تا آنجا که ممکن است جیوه موجود در پساب را کاهش داد چرا که فاضلابهای صنعتی حاوی فلزات سنگین یک تهدید جدی برای محیط و سلامت افراد هستند، در واحد پتروشیمی بندر امام به همراه پساب و فاضلابهای واحدهای عملیاتی مختلف بویژه واحد تولید کلر آلکالی مقدار قابل توجهی جیوه وارد محیط میگردد و از آنجاییکه جیوه مانند سایر فلزات سنگین قابل تجزیه توسط موجودات زنده نیست و تمایل به تجمع در ارگانیسمهای زنده را دارد باید بتوان با استفاده از روشهای گوناگون آن را تحت کنترل قرار داد، این روشهای مختلف در واقع روشهای فیزیکی، شیمیایی و بیولژیکی هستند که در نهایت باعث حذف جیوه موجود در پسابهای صنعتی خواهد شد.
ماهیت جیوه
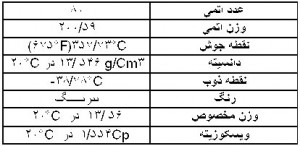
جیوه یکی از انواع فلزات سنگین است،(علت اطلاق واژه سنگین برای اینگونه فلزات در واقع وزن مخصوص بالاتر از ۶ گرم بر سانتیمتر مکعب این فلزات میباشد) در میان فلزات سنگین مانند آرسنیک، کادمیوم، نیکل، مس، سرب، روی و کروم، جیوه پایین ترین نقطه جوش را داراست و تنها فلزی است که در درجه حرارت یک اتاق معمولی بصورت مایع قابل مشاهد است! و از این نظر جیوه در میان همه فلزات دارای یک موقعیت ویژه است، بطوریکه از زمانهای بسیار دور نیز این خاصیت مورد شناسایی قرار گرفته بود و نام یونانی آنHydrargyrum به معنی نقره آبگون است از اینرو علامت Hg را در علم شیمی برای آن در نظر گرفتهاند و نام لاتین آن Argeentum Vivum هم به معنای نقره چابک یا سریع میباشد. جیوه یک فلز سمی و یک عنصر طبیعی است که از سولفید قرمز جیوه HgS بدست میآید، جیوه یک مایع بی بو، نقرهای سفید رنگ و براق است که اگر گرم شود به یک گاز بی بو و بی رنگ تبدیل میشود، این فلز به راحتی با گوگرد و هالوژنها ترکیب میشود و بر اسیدها غیر از اسید نیتریک گرم و غلیظ و مخلوط اسید نیتریک و اسید سولفوریک بی اثر است به لحاظ ثابت ماندن ضریب انبساط حرارتی جیوه در محدوده صفر تا ۳٠٠ درجه سانتیگراد از آن در ساختن دماسنجها و دستگاههای کنترل درجه حرارت و به لحاظ ناچیز بودن ضریب فشردگی آن در ساختن نانومترها استفاده میشود.
ضریب فشردگی = ] ( T-60)×۰٫۰۰۳۱+۳٫۷ ]× ۱۰
خاصیت مهم دیگر جیوه قابلیت حل کردن کلیه فلزات بجز آهن و پلاتین و تشکیل ملغمه است، که در دندانپزشکی کاربرد وسیعی دارد، ملغمهها اغلب در اثر الکترولیز محصولات فلزی که کاتد آن جیوه میباشد حاصل میشوند، باید توجه داشت که جیوه یکی از آلایندههای مهم محیط زیست نیز میباشد و در برخی کشورها مانند ژاپن و عراق سابفه نامطلوبی از خود بجا گذاشته است!
طرز تهیه جیوه
سنگ معدن جیوه بیشتر بصورت سولفور سرخ رنگ یا سینا بار با در جه خلوص ٨۶/۲ درصد است، برای بدست آوردن جیوه، آن را تا حدود ۶٠٠ درجه سانتیگراد در کورههای دوار حرارت می دهند تا گوگرد آن با اکسیژن ترکیب شده و بصورت آنهیدید سولفور از محیط خارج شود و آنگاه بخار جیوه را سرد میکنند.
HgS + O Hg + SO
مصارف جیوه
جیوه در صنایع و محصولات مختلفی استفاده میشود که برخی از آنها عبارتند از: تولید وسایل اندازه گیری (مانند دماسنج ها و فشار سنجها)، لامپهای الکتریکی، باتریها (بویژه باتریهای آلکالاین تا قبل از سال ١۹۹۶)، ترموستاتها، لامپهای فلورسنت، رنگهای لاتکس قدیمی، آینهها، دیگهای بخار جیوه و همچنین بعنوان کاتالیست برای اکسیداسیون ترکیبات آلی، استخراج طلا و نقره از سنگهای معدنی، کاتد در الکترولیز، یکسو کنندههای جریان برق، تولید کلر و کاغذها، آمالگامهای دانپزشکی، معرفهای آزمایشگاهی، گریس، رنگها حفاظت چوب، مواد منفجره و فتو گرافها و بسیاری از موارد صنعتی و غیر صنعتی دیگر.
همچنین تر کیبات جیوه در لوازم بهداشتی و آرایشی بعنوان کرمهای زیبایی، محافظ پوست و جلوگیری از آکنه بکار میروند، این فرآوریها که حاوی کالومل (کلرید جیوه) میباشند، ۶ تا ١٠ درصد وزنشان را جیوه تشکیل داده است و از آنجاییکه ترکیبات جیوه براحتی جذب پوست میشوند، سازمان نظارت بر مواد غذایی و دارویی آمریکا (FDA) استفاده از این ترکیبات را در فرآوردههای بهداشتی منع کرده است.
منابع بالقوه جیوه در محیط زیست
جیوه بعنوان یک گاز از منابع طبیعی و فعالیتهای انسانی مانند سوزاندن پسماندهها در کورههای شهرداریها و همینطور از کارخانجات صنعتی وارد هوا میشود و توسط اتمسفر حرکت کرده و بوسیله بارش شسته می شود، یکی دیگر از منابع بالقوه تولید جیوه احتراق سوختهای فسیلی میباشد بطوریکه پس از سوزاندن محصولات نفتی حاوی جیوه و یا زغال سنگ مقداری جیوه بطور سریع تبخیر و وارد اتمسفر میشود. شاید بتوان گفت مهمترین منبع آلودگی آبها به جیوه تخلیه فاضلابهای صنعتی کارخانههای کاغذ سازی، PVC و تولید کلر و سود میباشد، علاوه بر اینها جیوه از طریق فعالیت کارخانجات معدنی بویژه معدن طلا و ریخته گری نیز می تواند وارد محیط زیست ما شود، هرچند فعالیتهای انسانی بیشترین منابع بالقوه ایجاد جیوه در محیط زیست هستند اما باید توجه داشت که طبیعت نیز خود یکی از این عوامل بالقوه ایجاد جیوه میباشد بطوریکه جیوه از طریق رسوبات طبیعی، فعالیتهای آتشفشانی و فرسایش زمین و طوفان ها نیز وارد آب و خاک میشود.
اشکال مختلف جیوه در محیط زیست
جیوه در محیط به اشکال مختلف وجود دارد که این اشکال عبارتند از جیوه فلزی، ترکیبات ظرفیتی غیرآلی مانند کلرید جیوه، هیدرکسید جیوه و سولفید جیوه و ترکیبات آلی مانند یون متیل مرکوری، ترکیبات منومتیل مرکوری و دی متیل مرکوری.
جیوه فلزی با عناصر دیگری از قبیل کلرین، سولفور یا اکسیژن ترکیب میشود تا تشکیل جیوه غیرآلی یا نمکها را بدهد که بصورت پودرهای سفید یا کریستال هستند. جیوه همچنین با کربن نیز ترکیب میشود و سایر ترکیبات جیوه آلی را میسازد که یکی از عمدهترین آنها متیل کوری است که اغلب بوسیله ارگانیسمهای کوچک در آب و خاک تولید میشود، متیل کوری فرم بسیار سمی میباشد و میتواند در ماهی تیونا (Tuna) و در برخی موارد ماهی خار دار دریایی ساخته شود، شاید بتوان گفت مسمومیت از طریق خوردن ماهی های آلوده یکی از بزرگترین منابع مسمومیت برای اکثر مردم میباشد.
کلرآلکالی (CA ) : فرایندی است که طی آن از جیوه برای الکترولیز نمکها جهت تولید کلرید هیدروژن، هیدروکسید سدیم، سود سوزآور، مواد سفید کننده و محصولات دیگر استفاده میکنند.
چگونگی ورورد جیوه به زنجیره غذایی
مکانیسمهایی که بوسیله آنها جیوه وارد زنجیره غذایی میشود بطور کامل شناخته شده نیستند و ممکن است در میان اکوسیستمها متفاوت باشند در این رابطه برخی باکتریها نقش مهمی را بازی میکنند. باکتریهای موجود در محیط که در پروسه سولفات هستند، جیوه را از فرم معدنی غیرآلی میگیرند و آنرا بواسطه فرایند متابولیکی به متیل مرکوری تبدیل میکنند. تغییر جیوه معدنی به متیل مرکوری مهم است زیرا مقدار سم آن بیشتر میشود و ارگانیسمها بطور قابل ملاحظهای زمان طولانیتری را برای حذف متیل مرکوری نیاز خواهند داشت. باکتریهای حاوی متیل مرکوری ممکن است بوسیله سطح بالاتر در زنجیره غذایی مصرف شوند و یا باکتری ممکن است متیل کوری را بداخل آب دفع کند؛ جاییکه سریع بوسیله پلانکتونها جذب میشود که پلانکتونها نیز بوسیله سطح بعدی در زنجیره غذایی مصرف میشوند. بدلیل اینکه حیوانات متیل مرکوری را سریعتر از آنکه دفع کنند، آنرا انباشته میکنند بنابراین غلظت بالاتری از جیوه توسط جیوانات در هر سطح متوالی از زنجیره غذایی مصرف میشود، از این رو غلظتهای کم محیطی متیل مرکوری میتواند به آسانی به غلظتهای مضربالقوه در حیوانات بویژه ماهی و پرندگانی که ماهی مصرف میکنند ایجاد کند که در نهایت در بدن انسان تجمع پیدا کنند.
توکسیکو کینتیک: توکسیکو کینتیک جیوه که شامل جذب، انتشار، متابولیسم و دفع آن میباشد به میزان زیادی به فرم جیوهای که گیرنده در معرض آن قرار میگیرد بستگی دارد.
راههای تماس جیوه
جذب از طریق معده، ریهها و روده های ضعیفتر انجام میشود، بخار جیوه حتی میتواند از طریق پوست انسان به بدن وارد شود که منتهی به اغما و مرگ میشود. متیل مرکوری برای مخ و قشر مخ اثرات سمی دارد و موجب نکروز کانونی و تخریب سلولهای گلیال میشود، نکته قابل توجه آنکه ترکیبات آلی جیوه در مقایسه با ترکیبات معدنی آن سمی تر میباشند که علت آن انحلال و قدرت جذب بیشتر آنهاست.
مسمومیت جیوه و درمان آن
بر اساس گزارش های سازمان بهداشت جهانی (WHO ( در سال ١۹۹٠ میزان متوسط جیوه در خون و ادرار در جمعیت مردم عادی به ترتیب در حدود L / gμ ۸ و L / gμ ۴ می باشد. این میزان پایه میتواند در هنگام استفاده از آملگام های دانپزشکی و تغذیه از ماهیها به میزان قابل توجهی افزایش یابد.
راههای پیشگیری
۱ـ ایجاد محدودیت در مصرف ترکیبات جیوه.
۲ـ عدم استفاد از ضد قارچهای حاوی جیوه آلی فنیل مرکوری.
۳ـ استفاده از تجهیزات الکترونیکی به جای حرارت سنجهای دهانی حاوی جیوه و فشار سنجهای مورد استفاده در بخشهای پزشکی.
۴ـ عدم استفاده از نمکهای معدنی جیوه بعنوان یک نگه دارنده.
۵ـ مطالعه و بررسی ماهیان به منظور مشخص کردن آلودگی با متیل مرکوری.
نکات ایمنی
در صورت آلودگی محیط کار و یا آزمایشگاه با جیوه استفاده از سیستم خلا (دستگاههای مکنده برای جمعآوری قطرات جیوه) مناسبترین روش است همچنین با پاشیدن گوگرد در محیط آلوده و تبدیل جیوه به سولفورکه رنگ ارغوانی دارد، میتوان آنرا از بین برد و سپس شستشو داد.
شستشوی دستها با استفاده از صابونهای مخصوص با ترکیب ۱۸ % دی فنیل تیوکار با زون ۲٠٠ میلی لیتری اتانول آمین و ۷۵٠ میلی لیتر مایع صابون۵ % هیدرو کربینون صورت گیرد.
بدلیل جذب پوستی جیوه استفاده از دستکش لاستیکی هنگام کار ضروری است.
روشهای اندازه گیری جیوه
۱ـ روش دی تیزون.
۲ـ روش کروماتوگرافی (تیمار حرارتی).
۳ـ روش فعال سازی نوترون.
۴ـ روش جذب اتمی.
۵ـ روش مرکوری آنالیز(جدید).
منابع:
۱ـ مشکلات زیست محیطی صنعت کلر و راههای کاهش آن، «فصلنامه علمی محیط زیست».
۲ـ حذف فلزات سنگین از پسابهای صنعتی توسط باکتریهای احیا کننده سولفات، «پایان نامه کارشناسی ارشد بهداشت محیط»، مخزی هروی محمدرضا.
۳ـ بازیافت جیوه از پسابهای صنعتی ـ پتروشیمی، «پایان نامه کارشناسی ارشد مهندسی شیمی»، دانشگاه تربیت مدرس، نوروزی فروشانی محسن.
۴ـ آشنایی با واحد الکترولیز نمک و تولید کلروسود سوز آور، «نشریه ساختمان و نصب صنایع پتروشیمی»، آذری مریم.
۵ ـ جذب فلزات سنگین بوسیله کاتیونهای معدنی و ضایعات صنعتی، اسماعیلی عباس.
۶- Agency for toxic substances and Disease registry (ATSDR), Public Health Statement for Mercury.
7- Henry J.R An overview of the Phytoremediation of lead and mercury.Available in :
www.clu-in.org
8- Bargagli,R., Maserti, B.E.1988 Assesment of mercury distribution and partitioning in recent sediments of the western Mediterranean Basin.Sci.tot., Environ, 72, 123130.